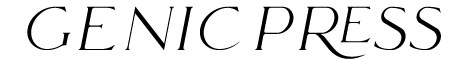順天堂大学大学院医学研究科細胞・分子薬理学の村山尚 准教授と、医学部薬理学講座の呉林なごみ 客員准教授、京都大学大学院薬学研究科の大鳥祐矢 大学院生と小川治夫 准教授らのグループは、東京慈恵会医科大学、昭和大学との共同で、1型リアノジン(*1)受容体(RyR1)のS5膜貫通セグメント(*2)(S5)による新たな制御機構を発見しました。RyR1は骨格筋筋小胞体(*3)のカルシウム遊離チャネル(*4)で、その遺伝子変異は先天性筋疾患の原因となります。S5はチャネルポアの形成には重要と考えられてきましたが、活性制御に対する作用は不明でした。研究グループはS5に存在する疾患変異を機能解析することで、S5がチャネル活性を正と負の二面的に制御する、いわゆる「一人二役」を担っていることを発見しました。本成果は筋疾患発症機構を解明するとともに、新規治療薬創製の可能性を示すものです。本論文はCommunications Biology誌のオンライン版に2024年9月18日付で公開されました。
本研究成果のポイント
●RyR1におけるS5上の疾患変異の機能解析を行い、構造学的視点により考察
●S5がチャネル活性を二面的に制御する「一人二役」を担っていることを発見
●RyR1関連筋疾患に対する新規創薬の可能性
背景
1型リアノジン受容体(RyR1)は骨格筋筋小胞体のカルシウム(Ca2+)遊離チャネルで筋収縮に重要な役割を果たしています。RyR1の遺伝子突然変異は悪性高熱症(MH)およびセントラルコア病(CCD)の原因となります。MHは外科手術時の吸入麻酔薬により高熱を発する疾患で、RyR1の機能亢進により起こります。一方、CCDは筋力低下を主な症状とする難病で、RyR1の機能低下が原因です。RyR1の膜貫通セグメントは6本から構成され、S5は約30アミノ酸からなる5番目のセグメントです。チャネルポアの形成に関与すると考えられていますが、チャネル活性制御に対する役割は不明でした。研究グループが疾患データベースを調べたところ、S5には10以上の疾患変異が存在し、MHとCCDの両方の変異が報告されていました。本研究ではS5によるRyR1チャネル制御機構を明らかにするため、S5に存在する疾患変異の網羅的な機能解析を行いました。
内容
本研究で解析したS5上の変異は11種類で3種類がMH、8種類がCCDの原因変異です(図1A)。野生型および疾患変異を有するRyR1をHEK293細胞(*5)に発現させ、機能解析を行いました。細胞内Ca2+濃度測定および[3H]リアノジン結合実験結果から、MH変異は機能亢進を、CCD変異は機能低下を引き起こすことが明らかとなりました(図1B)。次にこれらの変異がどのようなメカニズムでチャネル活性を変化させるのかを知るため、クライオ電子顕微鏡法(*6)により得られたRyR1の高分解能構造を用いて相互作用解析を行いました。RyR1チャネルが開口する際には、S6膜貫通セグメント(S6)の細胞質側が外側に倒れてゲートを開きます。一方、S6の小胞体内腔側はポアを形成し開口時にも動きません。S5はS6の隣に位置し、細胞質側が外側に倒れ、小胞体内腔側は動かないというS6に追従する動きをします。興味深いことに、MH変異が存在する細胞質側のアミノ酸残基はS6のアミノ酸残基と相互作用し、CCD変異が存在する小胞体内腔側のアミノ酸残基は他の膜貫通セグメントと複雑な相互作用をしていることを見出しました(図1C)。さらに、データベース検索により相互作用相手のアミノ酸残基にも疾患変異が存在することがわかりました。そこで、相互作用相手のアミノ酸残基に変異を導入してチャネル活性を調べたところ、相手方の変異も疾患変異と同様な機能変化を起こすことがわかりました。
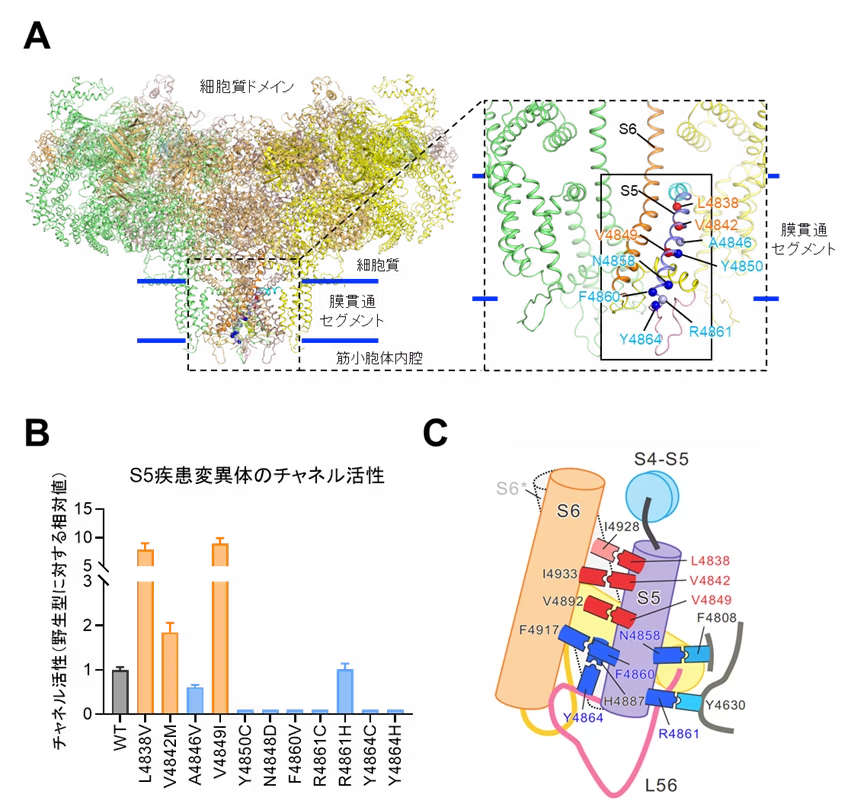
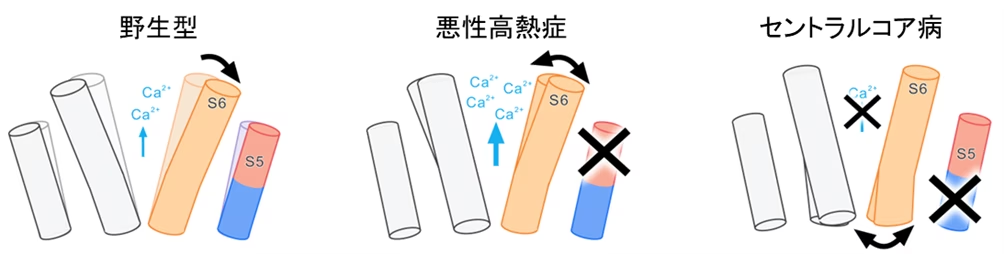
以上の結果から、S5は細胞質側でS6の動きを抑制的に制御していること、小胞体内腔側でチャネルの開閉に必要な構造基盤の維持に寄与していることが明らかとなりました(図2)。MH変異はS5による抑制を解除することで機能亢進が起こり(図2中央)、CCD変異は構造基盤の破壊により機能欠失を起こすことが示唆されました(図2右)。
今後の展開
今回、研究グループはチャネルポアの形成に重要だと思われていたS5に、チャネル活性制御を担う重要な新しい役割があることを解明しました。また、S5は30アミノ酸残基ほどの短いセグメントですが、細胞質側と小胞体内腔側とで異なる役割を持つ、すなわち「一人二役」を担っていることが初めて明らかとなりました。CCDは先天性の筋疾患で、現在、有効な治療法がありません。今回の研究で、RyR1チャネルの構造基盤の形成に異常が生じることが明らかになったことから、これらの異常を是正する薬物の開発が期待されます。
用語解説
*1 リアノジン: ヤナギ科の樹木Ryania speciosaから得られる植物アルカロイド。開口したRyRチャネルに特異的に結合する。放射線同位体([3H]リアノジン)はチャネル活性測定に使用される。
*2 膜貫通セグメント: 膜タンパク質の膜貫通領域。RyR1ではαヘリックスを形成している。
*3 筋小胞体: 骨格筋細胞内にあるカルシウムの貯蔵庫。
*4 カルシム(Ca2+)遊離チャネル: 筋収縮時に筋小胞体からCa2+を細胞質へ放出するCa2+チャネル
*5 HEK293細胞: ヒト胎児の腎由来の細胞株。
*6 クライオ電子顕微鏡法: 無染色で非晶質の氷に凍らせた生体分子を電子顕微鏡で撮影・解析する手法。
研究者のコメント
●疾患変異はタンパク質の機能や動作原理を解く重要なカギです。本研究では機能解析と構造解析の組み合わせによりS5の新しい役割を解明することが出来ました。RyR1には400以上の疾患変異が報告されています。これらの解析によりRyR1の動作原理に迫りたいと思います。(村山 尚)
●タンパク質の立体構造はその作動機構を紐解く上で強力な手がかりを与えてくれます。けれどもRyR1のような巨大なタンパク質の場合には情報量も膨大になり、構造情報のみではRyR1の疾患変異体が疾患を引き起こす要因等の理解は困難です。本研究ではこの困難な解析に、立体構造とそれに基づいた的確な機能解析研究を組み合わせることで成功しました。(小川 治夫)
原著論文
本研究はCommunications Biology誌のオンライン版に2024年9月18日付で公開されました。
タイトル:Dual role of the S5 segment in type 1 ryanodine receptor channel gating
タイトル(日本語訳): 1型リアノジン受容体チャネルゲーティングに対するS5セグメントの二面的な役割
著者: Takashi Murayama 1)*, Yuya Otori 2), Nagomi Kurebayashi 1), Toshiko Yamazawa 3), Hideto Oyamada 4), Takashi Sakurai 1) and Haruo Ogawa 2)* *Corresponding author
著者(日本語表記): 村山 尚1)*、大鳥 祐矢2)、呉林 なごみ1)、山澤 徳志子3)、小山田 英人4)、
櫻井 隆1)、小川 治夫2)* *共同責任著者
著者所属: 1)順天堂大学医学研究科 細胞・分子薬理学、2)京都大学大学院薬学研究科・構造生物薬学分野、3)東京慈恵会医科大学基盤研究施設、4)昭和大学薬理科学研究センター
DOI: 10.1038/s42003-024-06787-1
本研究はJSPS科研費(19H03404, 22H02805, 19K07105, 22K06652, 23K24778, 22H05055, 23K18453, 21H02411, 22K19375, 24K02164)をはじめとした支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。