hiPS-CMシート移植は重症心不全(*2)に対する国内発の新たな移植医療として世界中から大きな注目を集めていますが、移植後に生体内でどのような免疫反応が誘導されるか、その詳細なメカニズムは十分に解明されておらず、最適な免疫抑制戦略構築に向けた大きな課題でした。研究グループは、新たなヒト免疫マウスモデルを用いて、hiPS-CMシート移植ではCD8陽性T細胞主体的に免疫拒絶が誘導されることを初めて明らかにしました。本成果は、hiPS-CMシート移植においてCD8陽性T細胞免疫に焦点を絞った独自の免疫抑制戦略の可能性を示すものです。
■ 本研究成果のポイント
-
ヒトの免疫反応が部分的に再現したヒト免疫マウスを作成した
-
ヒトiPS細胞由来心筋細胞は、CD8陽性T細胞主体的な免疫拒絶が誘導される
-
ヒトiPS細胞由来心筋細胞シート移植における、最適な免疫抑制戦略構築が期待される
■ 背景
他家iPS細胞(他人の細胞から作成されたiPS細胞)を用いた再生医療は、難治性疾患に対する新たな治療法として大きく注目されています。共同研究者の宮川繁 教授、澤芳樹 名誉教授らの研究グループは、他家iPS細胞由来の心筋細胞を開発し、独自の技術でシート(hiPS-CMシート)を作成し、虚血により重度心不全に陥った心臓表面に移植することで、心機能が改善することを報告しました。他家iPS細胞は、生体内では「異物」と認識され、それを排除するよう免疫反応が誘導されます。それらを適切に制御するためには、hiPS-CMシート移植独自の免疫抑制戦略が不可欠です。これまでヒト白血球抗原(HLA: human leukocyte antigen)を適合させたiPS細胞株など、免疫反応が起きにくい細胞株の開発が精力的に行われてきました。しかしHLAを適合しても、すべての免疫反応を制御できるわけではありません。hiPS-CMシート移植後に生体内では、どの細胞が、どのような免疫反応を引き起こすのか、その詳細なメカニズムは十分にわかっておらず、最適な免疫抑制戦略構築に向けた大きな課題でした。そのためhiPS-CMシート移植では、これまでの非ヒト霊長類の研究結果から、心臓移植に準じた複数の免疫抑制剤(タクロリスム、ミコフェノール酸モフェチル、およびステロイド)が投与されています。しかし長期間の免疫抑制剤使用に伴う、腎機能障害や糖尿病などの代謝性疾患が増悪し、結果として原疾患の病態も悪化することでhiPS-CMシート移植による治療効果が十分に得られない可能性も懸念されていました。今回研究グループは、ヒトの免疫反応を部分的に再現可能なマウスモデルを構築し、hiPS-CMシート移植におけるヒトの免疫反応を解析しました。
■ 内容
まず、in vitro(試験管内)でhiPS-CMはどのような免疫反応を誘導するのかを評価しました。hiPS-CMと健常人のヒト末梢血単核球細胞を4日間混合培養し、培養後のヒト末梢血単核球細胞をフローサイトメトリーで解析し、どの細胞がhiPS-CMに反応するのか解析しました。hiPS-CMはHLA-class I のみ発現しており、ヒト末梢血単核球細胞のうちCD8陽性T細胞(*3)が活性化する程度で、誘導される免疫反応はわずかと考えられました。
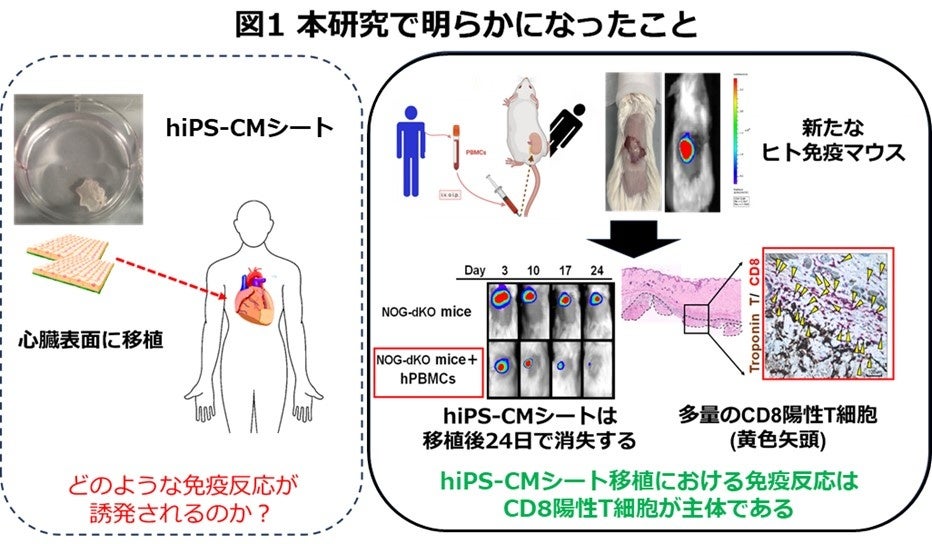
続いて、ヒト免疫マウスモデルを用いて、hiPS-CMシート移植後にin vivo(生体内)でどのような免疫反応が誘導されるのかを解析しました。生まれながらにリンパ球を持たない重度免疫不全マウス(*4)(NOG MHC double knockout マウス)に、hiPS-CMシートを移植したところ、移植片は長期間(>30日以上)生着しました。続いて、健常人の血液からヒト末梢血単核球細胞を分離し、重度免疫不全マウスに静脈投与し、ヒト免疫が部分的に再現したヒト免疫マウスを構築しました。このヒト免疫マウスにhiPS-CMシートを移植したところ、移植片は手術後10日ごろより著明に縮小し、17-24日で完全に消失しました。移植片を組織学的に解析したところ、心筋細胞のマーカーであるトロポニンT陽性細胞に周囲に多量のCD8陽性T細胞が浸潤しており、CD4陽性T細胞はわずかに認める程度でした。またこれらのCD8陽性T細胞は、GranzymeBやIFN-γを発現していたことから、実際に免疫拒絶に関与していることが考えられました。CD8陽性T細胞のみを除去したヒト免疫マウスに、同様にhiPS-CMシートを移植したところ、30日間以上生着しました。以上の結果から、hiPS-CMシート移植ではCD8陽性T細胞主体的に免疫拒絶が引き起こされることが明らかとなりました。また免疫抑制剤のkey drugであるタクロリムスを臨床濃度で投与したところ、これらの免疫反応が制御され、hiPS-CMシートは長期間(>30日以上)生着しました。
■ 今後の展開
今回、研究グループはhiPS-CMシート移植におけるの免疫反応メカニズムを初めて解明しました。今回の結果から、hiPS-CMシート移植における免疫反応は、主にCD8陽性T細胞によることが明らかとなり、CD4陽性T細胞およびCD8陽性T細胞の双方が免疫反応を引き起こす心臓移植と比較し、免疫拒絶も緩やかな可能性が示唆されました。研究グループは今回得られた知見をもとに、hiPS-CMシート移植に最適な免疫抑制戦略を検討していく予定です。また今回開発したヒト免疫マウスモデルは、他のiPS細胞移植やがんに対する免疫反応の解析、さらに細胞治療の有効性を評価するなど、様々な免疫反応の解析に応用されることも期待されます。
図1:本研究で明らかになったhiPS-CMシートの免疫拒絶メカニズム
hiPS-CMシート移植ではどのような免疫反応が誘発されるのか、そのメカニズムは不明であった。ヒト免疫マウスを用いてhiPS-CMシート移植では、CD8陽性T細胞が組織に集まり、免疫拒絶を引き起していることが明らかとなった。
■ 用語解説
*1 ヒトiPS細胞:様々な細胞へ分化誘導することが可能であり、新しい移植医療として注目されている。
*2 重度心不全:国内に10万人以上の患者が存在し、心臓移植以外に根治的な治療法がない難治性疾患である。
*3 CD8陽性T細胞 :異物を認識し、攻撃する免疫細胞。移植臓器に対する免疫拒絶反応に関与する。
*4 免疫不全マウス:遺伝子改変により重度に免疫機能を弱体化させたマウス。
■ 研究者のコメント
-
ヒトiPS細胞由来心筋細胞シート移植は、最も臨床応用の近い再生医療とされていますが、移植後の免疫反応メカニズムは十分に解明されていませんでした。本研究により、ヒトiPS細胞由来心筋細胞移植で誘導される免疫反応は、CD8陽性T細胞がその主体であることが明らかとなりました。今回得られた知見は、CD8陽性T細胞に着目した、効果的で副作用の少ない免疫抑制戦略構築が可能となることを示唆しています。国内には10万人以上の重度心不全患者が存在します。本研究成果により、ヒトiPS細胞由来心筋細胞シート移植の臨床応用が加速し、多くの患者さんに届くことを願っています。
■ 原著論文
本研究はThe journal of heart and lung transplantation誌のオンライン版で(2024年4月22日付)先行公開されました。
タイトル:CD8+ T cell-mediated rejection of allogenic human induced pluripotent stem cell-derived cardiomyocyte sheets in human PBMC-transferred NOG MHC double knockout mice
タイトル(日本語訳):ヒトiPS細胞由来心筋細胞シートはヒト免疫NOG MHC double knockout マウスにおいて、CD8+T細胞主体的に拒絶される
著者:Ryu Matsumoto R 1,2, Yin Enzhi1, Kazuyoshi Takeda1,3,4, Koudai Morimoto1, Kyoko Yogo1, Masaki Harada1, Koji Tokushige1, Yui Maehara1, Saori Hirota1, Yuko Kojima5, Mamoru Ito6, Nagako Sougawa7, Shigeru Miyagawa8, Yoshiki Sawa9, Ko Okumura1,8, and Koichiro Uchida1.
著者(日本語表記):松本 龍1,2, Yin Enzhi1, 竹田 和由1,3,4, 森本 弘大1, 余郷 享子1,原田 昌樹1, 徳重 宏二1, 前原 由依1, 広田 沙織1, 小島 裕子5, 伊藤 守6, 寒川 延子7, 宮川 繁7, 澤 芳樹7,奥村 康1,8, 内田 浩一郎1
著者所属:
1. 順天堂大学大学院 健康総合科学先端研究機構 免疫治療研究センター
2. 鹿児島大学大学院 医歯学総合研究科 消化器・乳腺甲状腺外科学
3. 順天堂大学大学院医学研究科 研究基盤センター 乳酸菌生体機能研究講座
4. 順天堂大学大学院医学研究科 研究基盤センター 細胞機能研究室
5. 順天堂大学大学院医学研究科 研究基盤センター 形態解析イメージング研究室
6. 公益在団法人 実験動物中央研究所
7. 大阪大学大学院医学系研究科 外科学講座 心臓血管外科学
8. 順天堂大学大学院医学研究科 アトピー疾患研究センター
DOI:10.1016/j.healun.2024.04.003
■ 研究支援
本研究は、日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「iPS再生組織・細胞移植における拒絶反応の免疫指標の確立と、誘導性抑制性T細胞を用いた再生組織の長期生着・免疫寛容の誘導(JP18bm0404027)」および 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「iPS細胞を用いた心筋再生治療創成拠点(JP21bm0204003)」の支援を受け実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。