発表のポイント
-
日本初の消化器がん患者さんを対象とした腸内細菌叢移植療法の安全性と有効性の検討を目的とする臨床試験を食道がん・胃がん患者さんを対象に開始しました。
-
近年、免疫チェックポイント阻害薬による治療効果が得られない患者さんに対して、腸内細菌叢を調節することで、治療の奏効割合が改善される可能性が示唆されています。
-
本試験の成果により、「免疫チェックポイント阻害薬と腸内細菌叢移植併用療法」を、がん患者さんの新たな治療選択肢として提供できるか検討します。
概要
国立研究開発法人国立がん研究センター(所在地:東京都中央区、理事長:中釜斉)中央病院(病院長:瀬戸泰之)と順天堂大学(所在地:東京都文京区、学長:代田浩之)、メタジェンセラピューティクス株式会社(所在地:山形県鶴岡市、代表取締役社長CEO:中原拓)は、2024年8月より「胃がん・食道がん患者に対する免疫チェックポイント阻害薬と腸内細菌叢(注1)移植(注2)併用療法」に関する臨床試験(注3)を開始します。
腸内細菌叢移植は、健康な人の便に含まれている腸内細菌叢を、内視鏡を用いて疾患を持つ患者さんの腸内に注入し、バランスのとれた腸内細菌叢を構築する医療技術で、免疫チェックポイント阻害薬治療との併用により奏効割合が改善される可能性が期待されています。
本試験は、日本初の消化器がん患者さんを対象とした「腸内細菌叢移植」の臨床試験で、食道がんおよび胃がんで免疫チェックポイント阻害薬による治療効果が得られない患者さんでの新たな治療選択肢とできるか検討します。
背景
近年、腸内細菌叢の研究は大きく進展し、さまざまな疾患との関連や、ヒトの免疫機能への影響が明らかになっています。(*1)
世界では腸内細菌叢に着目した治療の開発が進んでおり、米国や豪州では腸内細菌叢移植を応用した医薬品が難治性クロストリジウム・ディフィシル感染症の治療薬として、薬事承認されています(*2)。がん領域の腸内細菌叢移植研究(*3)では、免疫チェックポイント阻害薬による治療効果が得られない悪性黒色腫の患者さんに対して、腸内細菌叢移植により腸内細菌叢を調節することでがんに対する免疫が増強され、治療の奏効割合が改善される可能性が示唆されています。また、食道がんや胃がんを含む、さまざまながん種において、臨床試験が実施されています。
日本国内では、順天堂大学において、2023年1月より、潰瘍性大腸炎患者さんを対象とする「抗菌薬併用腸内細菌叢移植療法」を先進医療Bとして実施しています。メタジェンセラピューティクスは、同先進医療の共同研究機関として、便ドナーのリクルーティング、便検体の管理、腸内細菌叢溶液の調製、品質管理などに係る支援業務を提供しています。
本試験は、順天堂大学の腸内細菌叢移植の医療技術と、その支援を行うメタジェンセラピューティクスの「腸内細菌叢移植プラットフォーム」をがん領域に応用する、日本で初めての消化器がん患者さんを対象とした腸内細菌叢移植の臨床試験です。
さまざまながん種の中で、食道がんは2020年には約2.5万人が新たに食道がんと診断され、約1.1万人が亡くなっています*4。胃がんは日本で3番目に多いがんであり、2020年には約11万人が新たに胃がんと診断され、約4.2万人が亡くなっています(*4)。食道がんや胃がんの治療においては、免疫チェックポイント阻害薬により治療の選択肢が広がっている一方で、治療効果が得られない患者さんに対しての新たな治療法の開発が必要とされています。本試験の結果を踏まえ、本併用療法が、免疫チェックポイント阻害薬の奏効割合向上のための新たな治療選択肢として提供できるか検討します。
取り組みの詳細
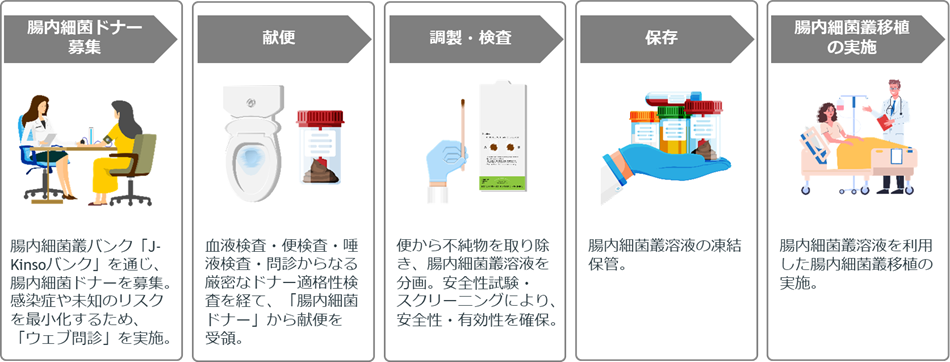
本試験では、切除不能進行・再発食道がんおよび胃がん患者さんを対象に、「免疫チェックポイント阻害薬と腸内細菌叢移植併用療法」を実施し、その安全性および有効性を検討します。対象となる患者さんに対して、抗菌薬3種類(アモキシシリン、ホスホマイシン、メトロニダゾール)を1週間投与した後、腸内細菌叢溶液を大腸内視鏡で1回投与する腸内細菌叢移植を実施します。腸内細菌叢移植の翌日以降より免疫チェックポイント阻害薬を含む治療を実施します。
腸内細菌叢移植は、健康な人の便に含まれている腸内細菌叢を、疾患を持つ患者さんの腸に内視鏡により注入し、バランスのとれた腸内細菌叢を構築する医療技術です。
なお、本試験において順天堂大学とメタジェンセラピューティクスは、腸内細菌叢溶液の調製等を共同で行います。適格性検査を通過した「腸内細菌ドナー」の便から、腸内細菌叢溶液を分画し、安全性試験・スクリーニングにより安全性・有効性を確保します。腸内細菌叢溶液は順天堂大学で調製、凍結保管の後に国立がん研究センターへ輸送され、腸内細菌叢移植実施時まで凍結状態で保管されます。
試験概要


国立がん研究センター中央病院 消化管内科
頭頸部・食道内科 科長
加藤健 コメント
「腸内細菌叢移植併用療法は、がん治療において注目が高まっている新たな療法です。諸外国に遅れを取ることなく、当院にてこの度日本で初めてとなる消化器がん患者さんを対象とした腸内細菌移植療法の臨床試験を開始できたことを大変嬉しく思います。本試験を通じて、免疫チェックポイント阻害薬の効果を高めることで、より有効な治療選択肢を提供できるよう、尽力してまいります。」

順天堂大学医学部内科学教室・消化器内科学講座 准教授
メタジェンセラピューティクス 取締役CMO
石川大 コメント
「順天堂大学にて2014年から始まった腸内細菌叢移植の臨床研究の症例数は、240例以上にのぼります。この度、その技術をがん患者さんに応用できること大変嬉しく思っています。腸内細菌叢移植は、潰瘍性大腸炎をはじめ、今後さまざまな疾患における治療の選択肢となる可能性を秘めています。研究の成果を多くの患者さんに一日でも早くお届けできるよう、研究を進めてまいります。」

メタジェンセラピューティクス 代表取締役社長CEO
中原拓 コメント
「メタジェンセラピューティクスには、日本における腸内細菌叢移植の第一人者である石川と、世界トップクラスの腸内細菌叢の研究者たちが集っています。弊社の腸内細菌叢に関する知識、腸内細菌叢移植(FMT:Fecal Microbiota Transplantation)の支援サービスや、FMT起点のリバーストランスレーショナル創薬(注4)プラットフォームによって、がん患者さんやそのご家族の皆様に新たな治療の選択肢を届けられるよう尽力してまいります。今回の臨床試験の開始により、消化器がんのみならず、さまざまながん種において腸内細菌叢移植併用療法の研究開発が進んでいくことを望んでいます。」
国立がん研究センター中央病院について
国立がん研究センター中央病院は、1962年に開設して以来、“社会と協働し、全ての国民に最適ながん医療を提供する”という理念のもと、がん治療・研究のリーディング・ホスピタルとして日本のがん医療を牽引しています。全ての臓器がんにおいてハイボリュームで質の高い医療提供体制を構築しており、多数の企業治験や医師主導治験、ファースト・イン・ヒューマン(FIH)試験、国際共同治験・臨床試験を強力に推進し、標準医療の確立と普及に取り組んでいます。
順天堂大学について
順天堂は、江戸後期の天保9(1838)年、江戸・薬研堀(現在の東日本橋)に開設したオランダ医学塾「和田塾」に端を発し、今につながる日本最古の西洋医学塾です。現在では、医学部・スポーツ健康科学部・医療看護学部・保健看護学部・国際教養学部・保健医療学部・医療科学部・健康データサイエンス学部・薬学部の9学部をはじめ、大学院5研究科、医学部附属6病院からなる「健康総合大学・大学院大学」として教育・研究・医療そしてリベラルアーツを通じて国際レベルの社会貢献と人材育成を進めております。
メタジェンセラピューティクス株式会社について
メタジェンセラピューティクス株式会社は「マイクロバイオームサイエンスで患者さんの願いを叶え続ける」ことをミッションとして、腸内細菌研究に基づいた医療と創薬でソーシャルインパクトを生み出す大学発ベンチャーです。 順天堂大学の医師と慶應義塾大学、東京工業大学の研究者が共同創業し、「腸内細菌叢移植(FMT)」の社会実装と、「FMT起点のリバーストランスレーショナル創薬」を推進しています。現在は、免疫疾患(炎症性腸疾患)、がん、中枢神経系疾患、アレルギー疾患領域の開発に注力しています。
用語解説
注1 腸内細菌叢(ちょうないさいきんそう)
ヒトの腸管には約1,000種、40兆個以上(*5)の腸内細菌が生息しており、その細菌の集団を腸内細菌叢(腸内フローラ)と言います。
注2 腸内細菌叢移植(FMT:Fecal Microbiota Transplantation)
腸内細菌叢移植(FMT)は、健康な人の便に含まれている腸内細菌叢を、疾患を持つ患者さんの腸に内視鏡により注入し、バランスのとれた腸内細菌叢を構築する医療技術です。
<参考リリース>
潰瘍性大腸炎を対象とした「抗菌薬併用腸内細菌叢移植療法」が先進医療Bとして承認、2023年1月より実施
【プレスリリース】潰瘍性大腸炎を対象とした「抗菌薬併用腸内細菌叢移植療法」が先進医療Bとして承認、2023年1月より実施
注3 臨床試験と臨床研究の違いについて
「臨床研究」とは人を対象に行われるすべての研究を指しますが、その中でも、薬の投与、手術、放射線治療などにより、人体に対して変化を伴う研究(介入研究)を臨床試験といいます。また、臨床試験の中でも特に、厚生労働省から薬・医療機器としての承認を得ることを目的として行う試験を「治験」といいます。
注4 FMT起点のリバーストランスレーショナル創薬
腸内細菌叢移植(FMT)であらかじめ安全性・有効性が確認できた腸内細菌叢を用いて行う創薬を意味します。通常の創薬では、基礎研究の成果を基に医薬品としての実用化を目指す「トランスレーショナルリサーチ」による創薬が行われますが、FMT起点の創薬は、臨床上で明らかになったメカニズムを基に研究を行い医薬品の実用化を目指す「リバーストランスレーショナルリサーチ」による創薬です。FMT起点のリバーストランスレーショナル創薬では、通常のリバーストランスレーショナルリサーチより、さらに安全性・有効性の確率性の高い開発を進めることができます。
*出典
1. Skelly AN, Sato Y, Kearney S, Honda K. Mining the microbiota for microbial and metabolite-based immunotherapies. Nat Rev Immunol. 2019 May;19(5):305-323. doi: 10.1038/s41577-019-0144-5.
2. Sudarshan Paramsothy, Michael A Kamm, Nadeem O Kaakoush, et al. Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. Lancet. 2017 Mar 25;389(10075):1218-1228. DOI: 10.1016/S0140-6736(17)30182-4
3. Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science. February 4, 2021. DOI: 10.1126/science.abf3363Christopher H Woelk 1, Alexandra Snyder, Modulating gut microbiota to treat cancer. Science. 2021 February 5, 2021.
DOI: 10.1126/science.abg2904.
Bertrand Routy et al., Fecal microbiota transplantation plus anti-PD-1 immunotherapy in advanced melanoma: a phase I trial. Nat Med. 2023 Aug;29(8):2121-2132. doi: 10.1038/s41591-023-02453-x.
4. 厚生労働省 全国がん登録 罹患数・率 報告 2020年
5. Sender, R., Fuchs, S. & Milo, R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 14, e1002533 (2016)